Termodynamiikka lämpövoimakoneen selittäjänä
”Thermodynamics is mainly concerned with the transformations of heat into mechanical work and the opposite transformations of mechanical work into heat.” [1]
Historiallisesti termodynamiikka on syntynyt tarpeesta ymmärtää, miten lämpövoimakone tekee työtä lämmön avulla. Klassiseen mekaniikkaan perustuva yksittäisen hiukkasen tarkastelu ei ole mahdollista, koska realistisessa koneessa hiukkasia on liikaa. Tämän vuoksi termodynamiikka muuttaa mikroskooppisen makroskooppiseksi ja tekee siinä samassa merkittäviäkin approksimaatioita. Lämpövoimakone saa tästä huolimatta selityksensä tavalla, jonka ymmärtämiseen lukion fysiikan opinnot riittävät hyvin.
Systeemi, tilanmuuttujat ja tilanyhtälö
Ennen kuin lämpövoimakoneen toimintaa voi analysoida täytyy sopia, miten konetta kuvataan. Todellisuudessahan kysymys on usein kaasun molekyyleistä sylinterissä ja kemiallisista reaktioista mutta termodynamiikka siirtää kuvauksen toiseen äärimmäisyyteen ja ottaa yksinkertaisimmillaan huomioon vain kolme peruspilaria.
- Systeemi on kaikki se, jota tarkastellaan. Lämpövoimakoneen tapauksessa systeemin muodostaa kaasu sylinterissä. Muu on ympäristöä, joka voi vuorovaikuttaa systeemin kanssa.
- Tilanmuuttujat kertovat systeemin makroskooppisen tilan. Ne tiivistävät muutamaan arvoon kaikkien systeemin hiukkasten mikroskooppiset tilat. Tilanmuuttujat voi periaatteessa valita miten tahansa mutta usein hyödyllisiä ovat esimerkiksi tilavuus, paine, lämpötila ja sisäenergia.
- Systeemi ja sen tilanmuuttujat eivät vielä kerro mitään siitä, millaista kaasua sylinterissä on. Tähän tarvitaan tilanyhtälö, joka sitoo yhteen tilanmuuttujia. Tunnetuin esimerkki on ideaalikaasun tilanyhtälö. Ideaalikaasu on kuvitteellinen kaasu, jota todelliset kaasut muistuttavat sitä enemmän mitä harvempia ne ovat ja mitä vähäisempi kaasun hiukkasten välinen vuorovaikutus on.
Ensimmäinen pääsääntö
Lämpövoimakoneen teorian ymmärtämisen kannalta termodynamiikan keskeinen kysymys on, miten lämpöä muuttuu työksi. Ensimmäinen pääsääntö tarjoaa yksinkertaisen vastauksen: Termodynaamisen systeemin sisäenergiaa voivat muuttaa systeemin vaihtama lämpö ympäristön kanssa sekä systeemin tekemä työ. Lisäksi nämä tavat ovat yhteismitallisia eli niillä on kvantitatiivinen yhteys
${\rm{\Delta }}U = Q – W$
Systeemin sisäenergiaa kasvattavat systeemiin tuotu lämpö $(Q > 0)$ ja systeemiin tehty työ $(W < 0)$. Vastaavasti sisäenergia pienenee, kun systeemi luovuttaa lämpöä ympäristöön $(Q < 0)$ tai tekee ympäristöön työtä $(W > 0)$.
Ensimmäinen pääsääntö tarjoaa jo lämpövoimakoneen idean. Jos systeemi on kaasu koneen sylinterissä, niin tuomalla siihen lämpöä, saadaan systeemin sisäenergiaa kasvatettua. Kasvaneen sisäenergiansa avulla kaasu voi laajentua tehden mekaanista työtä ympäristöön. Loppujen lopuksi systeemiin tuotu lämpö on muuttunut koneessa työksi.
Lämmön, työn ja sisäenergian yhteyttä voidaan tarkastella lähemmin, kun annetaan kaasun tilan muuttua jonkin termodynaamisen prosessin kautta. Yksinkertaisin esimerkki ensimmäisen pääsäännön mukaan toimivasta koneesta onkin sylinteri, jonka sisältämä ideaalikaasu laajenee isotermisesti. Ideaalikaasun sisäenergia on suoraan verrannollinen kaasun lämpötilaan, joten isotermisen laajenemisen aikana systeemin sisäenergia ei muutu. Koska kaasu tekee työtä laajetessaan, täytyy siihen tuoda jatkuvasti lisää lämpöä, jotta sen sisäenergia ei laskisi. Näin tuotu lämpö muuttuu jatkuvasti työksi.
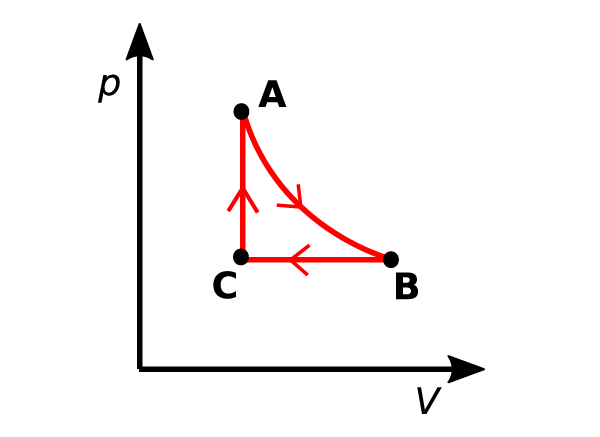
Tarkkaan ottaen pelkästään laajenevaa kaasua sylinterissä ei voi kutsua lämpövoimakoneeksi. Koneen prosessien täytyy nimittäin muodostaa suljettu kierto. Lämpövoimakone palaakin aina takaisin lähtötilaansa ja on valmis suorittamaan uuden kierron. Isotermisen laajenemisen jälkeen sylinterin kaasu voi esimerkiksi jäähtyä isobaarisesti takaisin alkutilavuuteensa ja tämän jälkeen palata isokoorisesti alkutilaansa. Tällainen kiertoprosessi on esitetty kuvassa 1. On helppo tarkistaa, että isotermisessä laajenemisessa koneen tekemä työ on suurempi kuin isobaarisessa jäähtymisessä koneeseen tehty työ, joten systeemi tekee kiertonsa aikana nettotyötä ympäristöön.
Toinen pääsääntö
Ensimmäinen pääsääntö mahdollisti lämmön muuttamisen työksi ja pitää samalla huolen energian säilymisestä termodynaamisissa prosesseissa. Lämmön muuntamisessa työksi on kuitenkin jotakin erityistä. Energianlajeja ei voi muuttaa toisikseen mielivaltaisesti vaan vain osa lämmöstä on mahdollista muuttaa työksi. Tätä tosiasiaa ei voi johtaa muista termodynamiikan oletuksista, joten sitä kutsutaan toiseksi pääsäännöksi. Kelvinin ja Planckin muotoilu on sopiva lämpövoimakoneiden tapauksessa: ”Mikään laite ei voi muuttaa kaikkea ottamaansa lämpöä työksi.” Toisin sanoen kaikkien lämpövoimakoneiden on myös luovutettava lämpöä kiertonsa aikana.
Edellä käsitellyssä kiertoprosessissa kone ottaa vastaan lämpöä ympäristöstä isotermillä A→B ja isokoorilla C→A mutta luovuttaa lämpöä ympäristöön isobaarilla B→C. Näin ollen toinenkin pääsääntö toteutuu. Koska kone kiertonsa tehtyään palaa takaisin alkuperäiseen tilaansa, sen sisäenergiakin tilanmuuttujana palaa takaisin alkuperäiseen arvoonsa. Niinpä ensimmäisen pääsäännön mukaan koneen kiertoprosessissa tekemä nettotyö on koneen ottaman lämmön ja luovuttaman lämmön erotus
$W = {Q_H} – {Q_L}$
missä molemmat lämmöt ovat positiivisia. [2]
On syytä huomata, että toinen pääsääntö ei ole seurausta siitä, että kone olisi epäideaalinen. Termodynamiikan oletuksena on, että prosessit ovat ideaalisia. Vaatimus koneen poistamasta lämmöstä on seurausta siitä, että lämpöä on alunperinkin otettu koneeseen.
Termodynamiikan toisen pääsäännön voi muotoilla useammalla eri tavalla, jotka ovat kaikki yhtäpitäviä. Arkihavaintoihin hyvin sopiva on Clausiuksen muotoilu: ”Mikään laite ei voi ainoastaan siirtää lämpöä matalammasta lämpötilasta korkeampaan.” Entropian avulla toinen pääsääntö voidaan myös kvantifioida ja pääsäännön muotoiluksi saadaan: ”Kaikissa spontaaneissa prosesseissa systeemin ja ympäristön yhteenlaskettu entropia kasvaa.”
Muita lämpövoimakoneiden ominaisuuksia
Kun kiertoprosessin idea on hahmotettu, on mahdollista suunnitella ja analysoida erilaisia lämpövoimakoneita. Ensimmäisissä arvioissa koneen ominaisuuksista voidaan olettaa, että koneen prosessit ovat reversiibeleitä ja että koneen sylinterissä on yksinkertaista ideaalikaasua. Teknisestä näkökulmasta mielenkiintoisia tunnuslukuja ovat ainakin hyötysuhde, puristussuhde, tehollinen keskipaine ja koneen teho.
Hyötysuhde on saavutetun hyödyn suhde käytettyyn panokseen. Lämpövoimakoneelle tämä on koneen kierron aikana tekemän työn ja koneeseen tuodun lämmön suhde: ${\rm{\eta }} = \frac{W}{{{Q_H}}}$. Toisesta pääsäännöstä seuraa, että lämpövoimakoneen hyötysuhde on aina pienempi kuin yksi, sillä kaikkea lämpöä ei voi muuttaa koneessa työksi. Kuvan 1 mukaisen kierron hyötysuhde on ${\rm{\eta }} = \frac{{{W_{A \to B}} – {W_{B \to C}}}}{{{Q_{A \to B}} + {Q_{C \to A}}}} = \frac{{{T_A}{\rm{ln}}\left( {{V_B}/{V_A}} \right) – \left( {{T_A} – {T_C}} \right)}}{{{T_A}{\rm{ln}}\left( {{V_B}/{V_A}} \right) + \frac{3}{2}\left( {{T_A} – {T_C}} \right)}} = \frac{{{p_A}{\rm{ln}}\left( {{V_B}/{V_A}} \right) – \left( {{p_A} – {p_C}} \right)}}{{{p_A}{\rm{ln}}\left( {{V_B}/{V_A}} \right) + \frac{3}{2}\left( {{p_A} – {p_C}} \right)}}$. Hyötysuhteen lausekkeesta voi johtaa useita eri versioita ideaalikaasun tilanyhtälöä käyttäen.
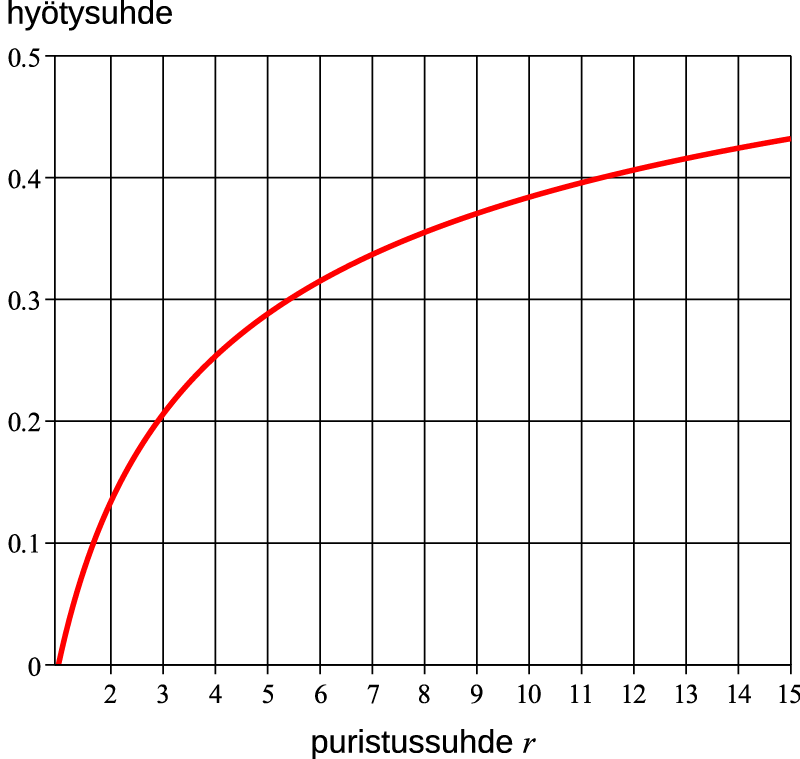
Puristussuhde on koneen suurimman ja pienimmän tilavuuden suhde. Se siis mittaa, kuinka paljon kone laajenee kiertonsa aikana. Monien lämpövoimakoneiden kiertojen hyötysuhde kasvaa puristussuhteen kasvaessa. Toisaalta suuri puristussuhde merkitsee sitä, että kone vaatii enemmän tilaa laajenemiseensa ja jossakin vaiheessa tämä tekee koneesta epäkäytännöllisen. Kuvan 1 kierrossa puristussuhde on suoraan määritelmän mukaan $r = {V_B}/{V_C} = {V_B}/{V_A}$ ja hyötysuhde ilmaistuna puristussuhteen avulla on ${\rm{\eta }} = \frac{{{p_B}r{\rm{ln}}\left( r \right) – \left( {{p_A} – {p_C}} \right)}}{{{p_B}r{\rm{ln}}\left( r \right) + \frac{3}{2}\left( {{p_A} – {p_C}} \right)}} = \frac{{r{\rm{ln}}\left( r \right) – \left( {r – 1} \right)}}{{r{\rm{ln}}\left( r \right) + \frac{3}{2}\left( {r – 1} \right)}}$. Tämä on esitetty kuvassa 2, josta havaitaan, että puristussuhteen kasvaessa myös hyötysuhde kasvaa mutta sitä hitaammin, mitä suuremmaksi puristussuhde kasvaa.
Tehollinen keskipaine on koneen kiertonsa aikana tekemän työn suhde sen tilavuuden muutokseen kierron aikana, ${p_{{\rm{tkp}}}} = \frac{W}{{{\rm{\Delta }}V}}$. Sen avulla pyritään kuvamaan koneessa vaikuttavaa keskimääräistä painetta. Koska todellisessa koneessa on aina mekaanisesta toteutuksesta johtuvia häviöitä, matalasta tehollisesta keskipaineesta seuraa, että mekaanisten häviöiden osuus koneen tekemästä työstä on suuri. Esimerkiksi kuvan 1 mukaisen koneen tehollinen keskipaine on ${p_{{\rm{tkp}}}} = {p_B}\left( {\frac{{{V_B}}}{{{V_B} – {V_A}}}{\rm{ln}}\left( {\frac{{{V_B}}}{{{V_A}}}} \right) – 1} \right) = {p_B}\left( {\frac{r}{{r – 1}}{\rm{ln}}\left( r \right) – 1} \right)$ puristussuhteen avulla ilmaistuna. Vastaavasti koneen hyötysuhde ilmaistuna tehollisen keskipaineen avulla on ${\rm{\eta }} = \frac{{{p_{{\rm{tkp}}}}}}{{{p_{{\rm{tkp}}}} + \frac{5}{2}{p_B}}}$.
Teho on suure, joka ilmaisee, kuinka nopeasti lämpövoimakone tekee työtä. Tehoon vaikuttavat sekä yhdessä kierrossa tehty työ että kiertoon kulunut aika. Termodynamiikka itsessään kiinnittää huomiota vain työhön eikä prosesseihin kulunut aika ole merkityksellistä. Todellisuudessa kuitenkin liian hitaasti toimivan koneen teho jää pieneksi eikä tällaista konetta kannata rakentaa. Oleellista on, että hyötysuhteella ja teholla ei ole suoraa yhteyttä. Esimerkiksi isoterminen prosessi on teknisesti hyvin hidas toteuttaa, koska systeemin lämpötilan pitää antaa jatkuvasti tasoittua mutta toisaalta isotermisen prosessin avulla voi toteuttaa kiertoja, joilla on hyvin korkea hyötysuhde. Tällainen on esimerkiksi kuuluisa Carnot’n kierto.
Viittet
[1] Enrico Fermi: Thermodynamics, Prentice-Hall 1937.
[2] Koneen kiertoprosessia käsitellessä sekä koneen ottamaa että luovuttamaa lämpöä pidetään positiivisina toisin kuin ensimmäisen pääsäännön tapauksessa. Tähän on vaikea keksiä mitään kovin hyvää syytä.







