Kemian koe ylioppilastutkinnossa keväällä 2020
Kevään 2020 ylioppilaskokeen tehtävissä etsittiin metsän kätkemiä aarteita, tislattiin, tutkittiin galvaanista kennoa ja penisilliinien toimintaa sekä määritettiin alstoniittimineraalin koostumus. Lopuksi vertailtiin nykyistä ja Mendelejevin järjestämää alkuaineiden jaksollista järjestelmää. Koe koettiin helpoksi, mutta arvosanojen pisterajat pysyivät entisellä tasolla.
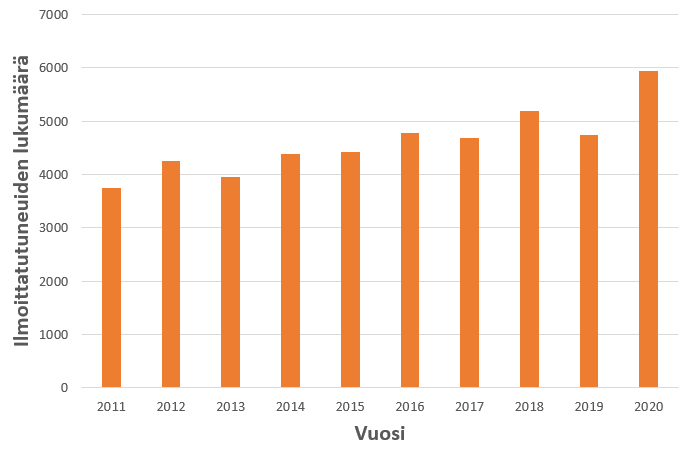
Kokeeseen ilmoittautui 5937 kokelasta, joista kokeeseen osallistui 5360. Koronavirusepidemian takia koetta aikaistettiin viikolla. Tämä vähensi hieman kokeen osanottajamäärää, mutta vaikutus ei ollut suuri. Kymmenen vuoden aikana kemian ylioppilaskokeeseen ilmoittautuneiden kokelaiden lukumäärät ovat kasvaneet yli 50
Kaikki tehtävät edellyttivät kemian ymmärtämistä sekä osiossa III lyhyiden aineistojen omaksumista ja soveltamista. Jos kokelas valitsi kaikki laskennallisuutta sisältävät tehtävät, laskujen pisteosuudeksi muodostui 51 pistettä, joka on 43
Kemian tehtäväkohtaiset kommentit
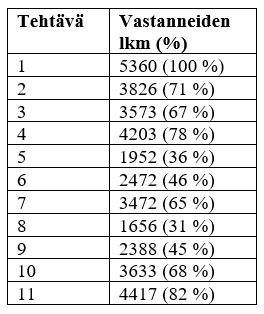
Kemian ylioppilaskokeen tehtävät on julkaistu verkossa.[1] Taulukkoon 1 on koottu kuhunkin tehtävään vastanneiden lukumäärät. Kaikille pakolliseen tehtävään 1 oli laadittu monivalintatehtäviä kemian eri osa-alueilta. Entiseen tapaan tehtävän tavoitteena oli testata kemian perusosaamista selkeillä vastausvaihtoehdoilla. Tehtävä oli varsin hyvin osattu (kuva 2). Eniten keskustelua herätti kohta 1.8., jossa tehtävänannon lauseen ”Heikon hapon” jatkoksi piti valita jokin seuraavista: a) syövyttämiskyky on heikko, b) konsentraatio on pieni, c) vastinemäs on heikko emäs, d) molekyyleistä vain osa muodostaa vesiliuoksessa vastinemäksen. Näistä vaihtoehto d) on selvästi oikein. Sen sijaan muut vaihtoehdot a-c) eivät päde yleisesti heikoille hapoille. ”Aina”-sana vastausvaihtoehdoissa olisi helpottanut valintaa, liikaakin, koska ”aina”-sanan sisältävät vastausvaihtoehdot ovat kemiassa lähes aina epätosia vaihtoehtoja. Erityisen haasteelliseksi koettiin valinta vaihtoehtojen c) ja d) välillä. Heikon hapon vastinemäs ei kuitenkaan ole aina heikko. MAOL-taulukoista löytyy yksi tällainen esimerkki, heikko happo vesi, jonka vastinemäs hydroksidi-ioni on vahva emäs. Muitakin vastaavia heikkoja happoja on olemassa, kuten alkoholit, joskaan niiden vastinemäksiin ei lukiokursseissa keskitytä. Tehtävässä ei hyväksytty vaihtoehtoa c) vaihtoehdon d) rinnalle, koska tehtävän vaikeus ei ole peruste hyväksyä vääriä vastauksia, jos kokelaiden on kuitenkin ollut mahdollista olemassa olevalla tietotasollaan ratkaista tehtävä oikein.
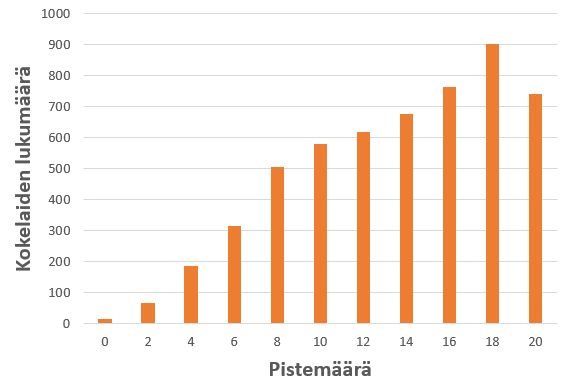
Tehtävässä 2 valmistettiin NaOH-liuos ja määritettiin sen tarkka konsentraatio titrauksella. Tehtävä testasi peruslaskemista, jossa tuli hallita moolimassan, ainemäärän ja konsentraation laskeminen sekä titrausreaktion stoikiometria ja yksikönmuunnokset. Tehtävään vastanneista kokelaista 37,1
Tehtävä 3 käsitteli mangaani(IV)oksidin tasapainoreaktiota. Kokelaan tuli analysoida, miten tasapainoasema muuttuu, kun lähtöainetta tai tuotetta lisätään tai poistetaan, reaktioastian kansi avataan, seosta kuumennetaan tai kun seokseen lisätään kiinteää hopeakloridia. Odotetusti vaikein oli viimeinen kohta, jossa piti oivaltaa hopeakloridin niukkaliukoisuus veteen. Tällöin sen vaikutus tasapainoon on erittäin vähäinen. Tehtävä osattiin siitä huolimatta hyvin, ja 29,0
Tehtävä 4 kietoutui puista eristettävien aineiden ympärille. Tehtävässä piti nimetä vanilliinin funktionaaliset ryhmät, piirtää vanilliinin jonkin paikkaisomeerin rakennekaava sekä tunnistaa hydroksimatairesinolin hapettuvat funktionaaliset ryhmät. Tehtävä osoittautui hyvin erottelevaksi sekä yllättävän haastavaksi, ja kokelaat jakautuivat varsin tasaisesti koko tehtävän pistevälille. Tehtävä osoitti kokelaiden omaksuneen hyvin Marvin Sketch-ohjelman orgaanisten yhdisteiden rakennekaavojen piirtämisessä.
Tehtävään 5 lyötiin kierrepallona galvaaninen kenno. Aineiston taulukosta tuli valita hapettumis-pelkistymisparit, joilla kennon lähdejännite olisi suurin sekä laskea tällöin lähdejännite ja merkitä kuvaan kennon elektrodit, puolikennon liuokset ja elektronien suunta. Kokelaan tuli oivaltaa toisen elektrodin olevan passiivinen elektrodi. Lisäksi tuli päätellä, mitä elektrodeille ja ionien konsentraatioille tapahtuu, kun kennosta otetaan virtaa. Galvaanista kennoa lähestyttiin siten hieman erilaisesta tulokulmasta, ja ehkä siksi tehtävä oli toiseksi vähiten vastattu (36
Tehtävässä 6 oli tislausvideo, joka kuvasi kahden komponentin tislauksen. Videosta piti päätellä, mitä kahta liuotinta seos sisälsi sekä selittää tislauksen toimintaperiaate ja työturvallisuustekijät. Tehtävä oli hyvin selväpiirteinen, ja moni kokelas osasi kirjoittaa eheän pienen esseen, jossa tehtävän kannalta keskeiset asiat käsiteltiin johdonmukaisesti. Niinpä 68
Tehtävässä 7 tuli analysoida metanolin valmistusreaktion lähtöaineiden ja tuotemetanolin konsentraatioiden muuttumista reaktion edetessä: Miten ja miksi konsentraatiot muuttuvat? Missä kohdissa metanolin muodostumis- ja hajoamisnopeudet ovat suurimmillaan? Kuten tehtävässä 6, tässäkin piti tuottaa asiapitoinen esseetyyppinen vastaus, joskin sen ratkaiseminen edellytti kuvaajan tulkintaa. Tehtävästä oli helppo saada muutamia pisteitä, mutta täysien pisteiden saaminen edellytti varsin syvällistä reaktion analysointia. Täydet pisteet sai 1,6
Tehtävässä 8 määritettiin kalsium- ja bariumkarbonaatin osuudet alstoniittimineraalissa. Seoslasku oli tavanomainen, joskin vaikeahko. Tehtävään vastanneet useimmiten myös osasivat tehtävän hyvin. Tehtävään vastanneista kokelaista 50,1
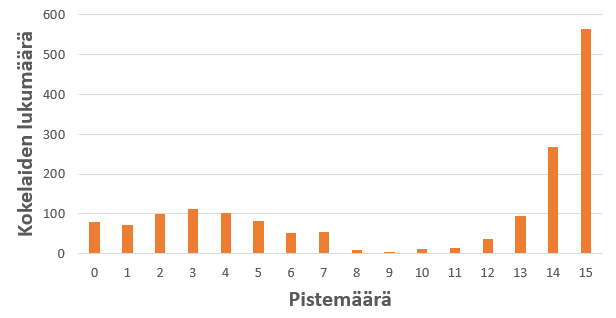
Tehtävässä 9 oli ensin omaksuttava ionivahvuuteen liittyvä aineisto, jotta tehtävässä pääsi edes alkuun. Sen jälkeen aineistoa piti soveltaa ionivahvuuteen liittyvään laskuun ja edelleen puskuriliuoksen pH-arvon laskemiseen. Aineisto tutustutti siis kokelasta lukiokurssin ulkopuoliseen käsitteeseen (ionivahvuus) mutta uusi tieto sovellettiin kuitenkin tuttuun tilanteeseen (puskuriliuos). Tehtävä sisälsi lukuisia kompastuskiviä: kideveden huomioiminen, suolan liukenemisessa muodostuvat ionit ja niiden konsentraatiot sekä ionivahvuuden laskeminen. Vaikka puskuriliuoslasku oli tavanomainen, sitä ennen oli kyettävä laskemaan liuoksen ionivahvuus ja määrittämään sen perusteella hapon happovakion arvo. Mikäli tehtävän alussa teki karkean virheen, jatkona seuranneesta puskuriliuoslaskusta ei myönnetty pisteitä. Tehtävä 9 erotteli kokelaat hyvin (kuva 4).
Tehtävässä 10 syvennyttiin penisilliinien rakenteeseen ja ajankohtaiseen antibioottiresistenssiin. Tehtävässä piti oivaltaa selitys V-penisilliinin nelirenkaan reaktiivisuudelle sekä pohtia, mitä penisilliinille voi tapahtua säilytyksessä ja miksei penisilliinin vaihto toiseen penisilliiniin auta, jos antibioottiresistenssi on kehittynyt. Nelirenkaan reaktioherkkyyden täsmällisen syyn muotoileminen osoittautui varsin haasteelliseksi. On kuitenkin hyvä huomata, että reaktioherkkyys on selitettävissä suhteellisen yksinkertaisella sidoskulmien analyysillä. Penisilliinin säilytyksessä tapahtuvan hajoamisprosessin arvostelussa kiinnitettiin huomiota vastauksen loogisuuteen. Lopuksi tarkasteltiin amoksisilliinin yhtä reaktiota, sen reaktiotyyppiä ja reaktiossa syntyvää tuotetta, mikä oli penisilliinitehtäväsarjan helpoin osa. Tehtävän pistejakauma muistutti Gaussin käyrää, jossa huippu kohdistui 9-12 pisteen välille.
Tehtävässä 11 oli annettu Dimitri Mendelejevin laatima alkuaineiden jaksollinen järjestelmä. Siitä piti tunnistaa neljä puuttuvaa alkuainetta, analysoida Mendelejevin jaksollista järjestelmää sekä vertailla sitä nykyiseen jaksolliseen järjestelmään. Monissa vastauksissa kuvattiin ansiokkaasti nykyistä järjestelmää, mutta selityksestä ei saanut pisteitä ilman vertailua Mendelejevin järjestelmän vastaaviin kohtiin. Lopuksi oli sovellettava alkuaineisiin liittyvää kemiallista tietoa, ja arvioitava, miksei Mendelejevin järjestelmästä puuttuvia alkuaineita tunnettu 1800-luvulla. Tehtävä 11 oli osion 3 tehtävistä eniten vastattu (Taulukko 1), ja sen pistejakauma muistutti tehtävän 10 tapaan Gaussin käyrää, jonka huippu kohdistui selvästi 9 pisteen kohdalle.
Palautteiden perusteella koe koettiin kokonaisuutena opetussuunnitelman mukaiseksi hyväksi peruskokeeksi ja vaikeustasoltaan sopivaksi.
Viitteet:
[1] Yle Abitreenit: https://yle.fi/aihe/artikkeli/2020/02/11/2020-kevat-kemia, viitattu 29.6.2020.







